生物大分子藥物是一類利用現代生物技術方法生產的源自生物體內并被用于疾病的診斷、治療或預防的生物大分子,狹義上也被稱為生物技術藥物,如疫苗、抗體藥物,包括單克隆抗體、抗體偶聯藥物(ADC)、雙特異性抗體、Fc 融合蛋白、抗體片段、多克隆抗體等。與化學合成藥物相比,生物大分子藥物具有相對分子量大,結構復雜、不易透過生物膜、給藥劑量低和易在體內降解等特點。隨著生物技術的迅猛發展,生物大分子藥物已被廣泛用于治療腫瘤、自身免疫性疾病和代謝性疾病等多種疾病。然而因此類藥物生產技術和本身分子量較大等特點,大分子藥物往往會出現免疫原(Immunogenicity)。
免疫原性(Immunogenicity)是當治療類蛋白產品作為某些疾病的治療藥物時,被機體識別為外來物質(抗原)而產生的免疫應答。然而對于治療性蛋白的這一免疫應答往往是不必要或非預期的,且在此應答過程中可導致機體產生抗藥抗體(Anti-drug antibodies,ADAs),包括抗藥抗體、中和抗體、免疫復合物等,ADA的存在可影響藥物的生物學活性、藥代動力學參數,甚至使得藥物原有的療效降低或缺失,而當有些免疫應答與機體內源性蛋白產生交叉免疫反應,則可能帶來嚴重的臨床安全問題。
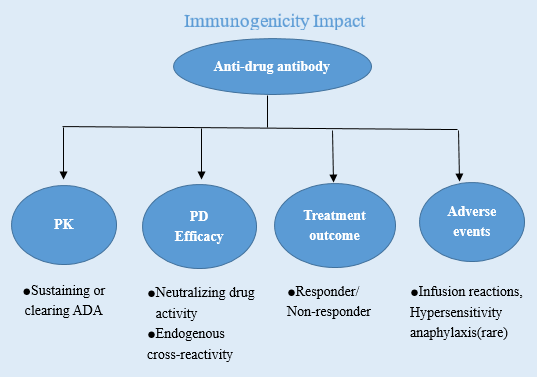
圖一 免疫原性的影響
正是基于此, 免疫原性的評估亟需相關技術規范文件予以支持。
2007年歐洲藥品監管機構(EMA)的人用藥品委員會 (CHMP) 發布免疫原性評估的指導原則但并未對如何產生相應數據數據作出詳細規定,在2017年EMA發布了該指導原則的最終版本(Final Version),但仍沒有出現技術細節上的詳細規定,EMA貫徹其適用目的原則(fit to purpose, FTP),要求申辦方選擇最優的方法來響應或滿足監管要求,具有相對靈活性。
美國FDA則于2014年首次發布了免疫原性評估指導原則,其中給出免疫原性的影響因素和評價策略。并于2019年發布的免疫原性評估指導原則《Immunogenicity Testing of Therapeutic Protein Products —Developing and Validating Assays for Anti-Drug Antibody Detection Guidance for Industry 》中將“免疫原性”定義為治療性蛋白產品對自身和相關蛋白產生免疫應答或誘發免疫相關臨床不良事件的傾向。
國家藥品監督管理局(NMPA)于2020年08月24日發布了《藥物免疫原性研究技術指導原則(征求意見稿)》,并于2021年03月29日發布正式版本,其總體的評估策略與FDA相同,與已有的FDA和EMA指導原則有所不同,NMPA正式版則充分考慮到了非臨床和臨床研究中免疫原性檢測方法的差別。這一指導原則的出臺,為國內免疫原性相關研究提供了至關重要的規范性指導。
對于ADA的檢測,NMPA、FDA、EMA的檢測決策基本一致,三者均提倡多層級的評估策略:
(1)篩選試驗:對所有樣本進行,篩選出疑似陽性樣品;
(2)確證試驗:對疑似陽性樣本進行特異性的確證試驗,確定陽性樣本;
(3)滴度試驗:對已確定抗體陽性的樣本進行滴度試驗,確定陽性相對強弱;功能性試驗對抗體進行中和活性檢測。
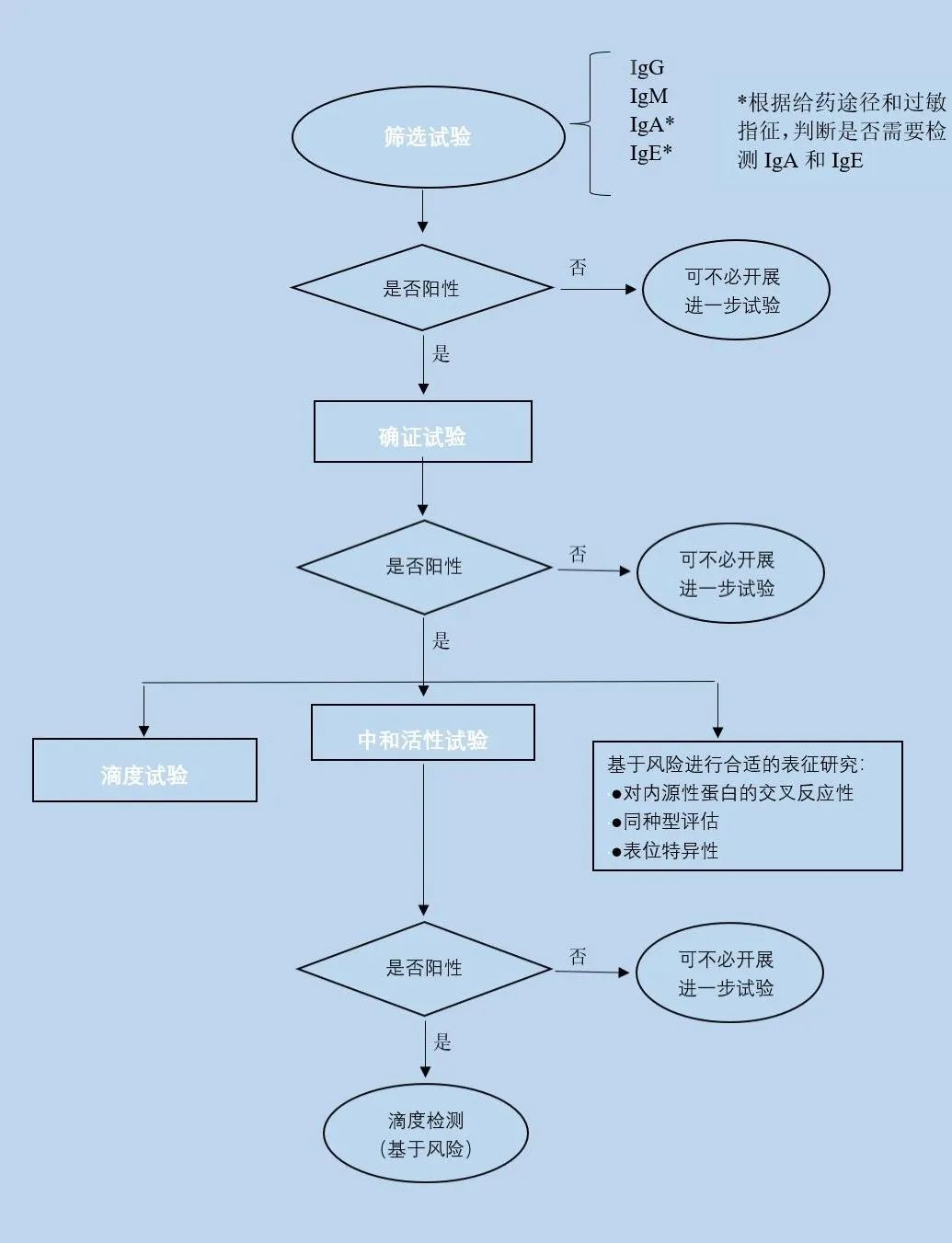
圖二 ADA檢測的分級評估策略
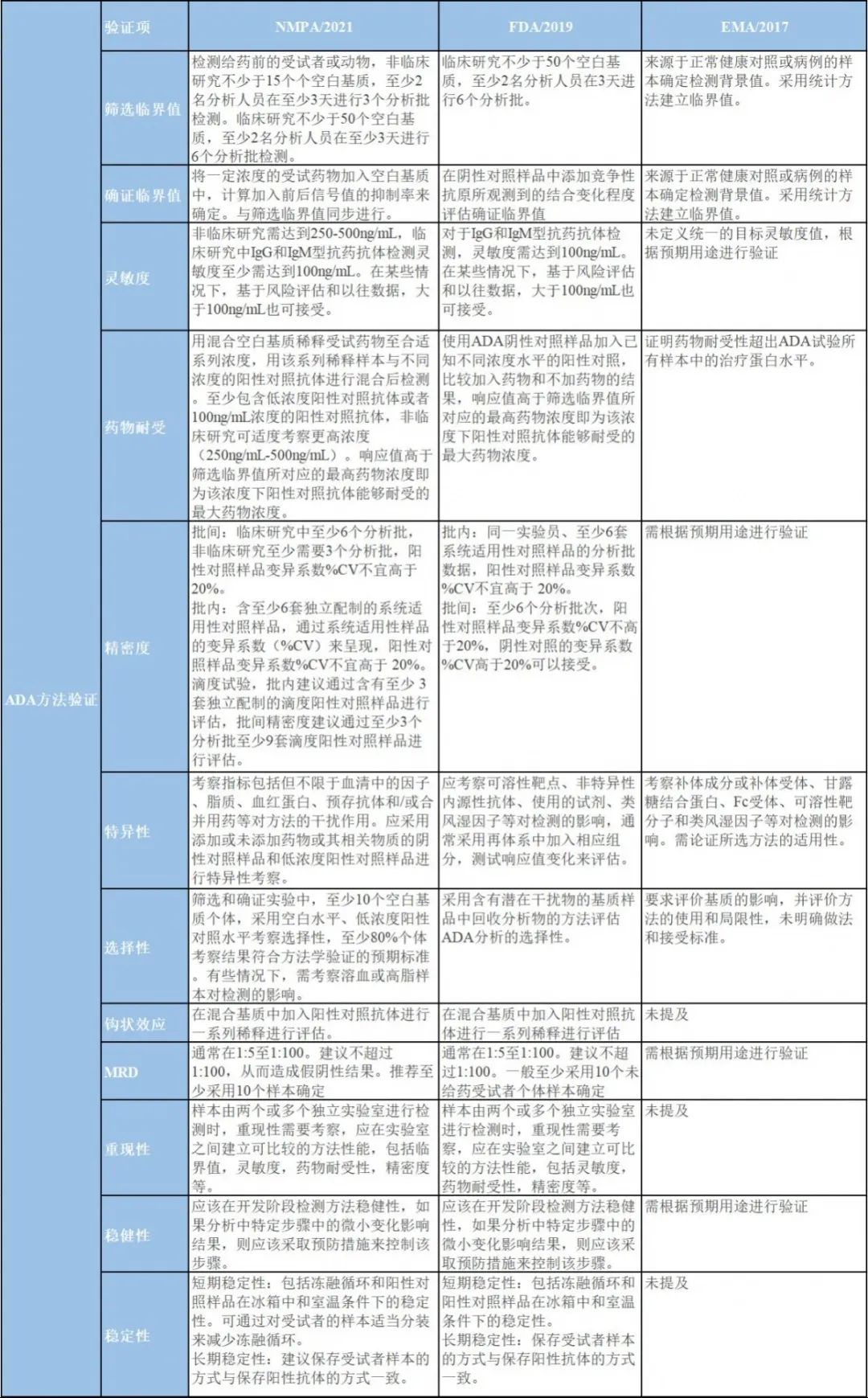
圖三 NMPA、FDA、EMA指導原則中驗證的內容和接受標準異同點
對于抗藥抗體檢測針對不同的檢測需求和難度可以采用不同的方法和儀器,包含但不局限于:直接法、橋聯法和均相結合法等。傳統的檢測儀器有酶標儀、MSD等,目前基于MSD(電化學發光) 平臺的橋接法是ADA檢測中最經典的方法。而在安徽萬邦醫藥分析測試中心平臺正擁有此類完善的檢測設備和多年的生物分析經驗,檢測能力涵蓋藥代動力學(PK),藥效學(PD),抗藥抗體(ADA),中和抗體(NAb),和生物標志物(Biomarker)檢測等,可根據客戶需求提供完善的方法學開發、驗證和生物樣本檢測服務,歡迎全國各地的朋友前來合作咨詢。

參考資料
[1]《藥物免疫原性研究技術指導原則(征求意見稿)》NMPA, 2020.08
[2]《藥物免疫原性研究技術指導原則》,NMPA, 2021.03.
[3]Immunogenicity Testing of Therapeutic Protein Products — Developing and Validating Assays for Anti-Drug Antibody Detection Guidance for Industry, January 2019.
[4]Guide line on Immunogenicity assessment of biotechnology-derived therapeutic proteins (EMEA/CHMP/BMWP/14327/2006 Rev 1), 1st Dec 2017.
